- Autorius Alex Aldridge [email protected].
- Public 2023-12-17 13:44.
- Paskutinį kartą keistas 2025-06-01 07:37.
Pagrindinis skirtumas - metanas vs etanas
Metanas ir Etanas yra mažiausi alkanų šeimos nariai. Šių dviejų organinių junginių molekulinės formulės yra atitinkamai CH4 ir C2H6. pagrindinis skirtumas tarp metano ir etano yra jų cheminė struktūra; Etano molekulė gali būti laikoma dviem metilo grupėmis, sujungtomis kaip metilo grupių dimeras. Kiti cheminiai ir fiziniai skirtumai daugiausia atsiranda dėl šio struktūrinio skirtumo.
Kas yra metanas?
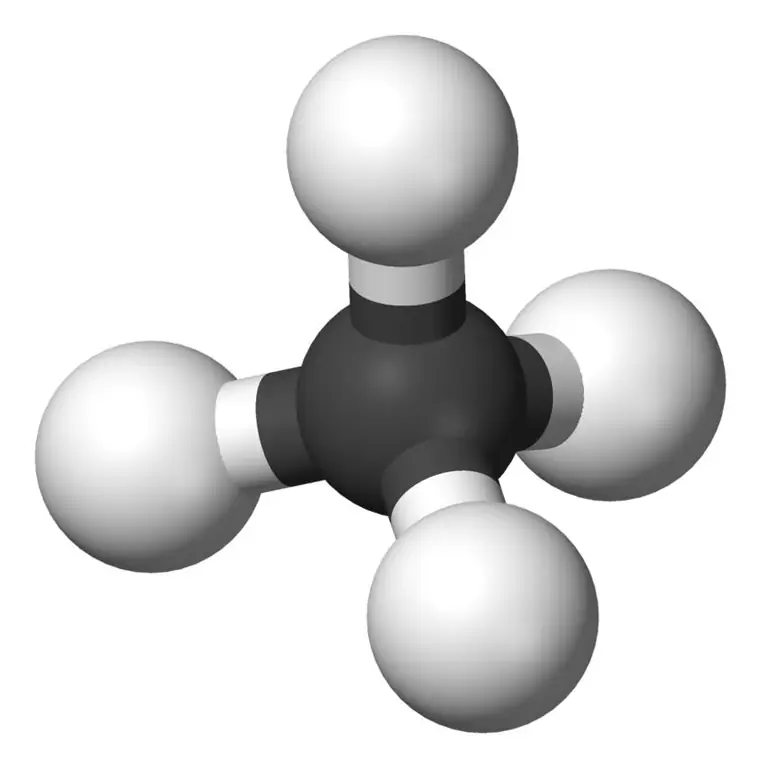
Metanas yra mažiausias alkanų šeimos narys, kurio cheminė formulė yra CH4(keturi vandenilio atomai yra prijungti prie vieno anglies atomo). Jis laikomas pagrindine gamtinių dujų sudedamąja dalimi. Metanas yra bespalvės, bekvapės ir beskonės dujos; taip pat žinomas kaip karbanas, pelkės dujos, gamtinės dujos, anglies tetrahidridas ir vandenilio karbidas. Jį galima lengvai užsidegti, o jo garai yra lengvesni už orą.
Metano natūraliai randama po žeme ir po jūros dugnu. Atmosferos metanas laikomas šiltnamio efektą sukeliančiomis dujomis. Metanas suyra į CH3- su vandeniu atmosferoje.
Kas yra Etanas?
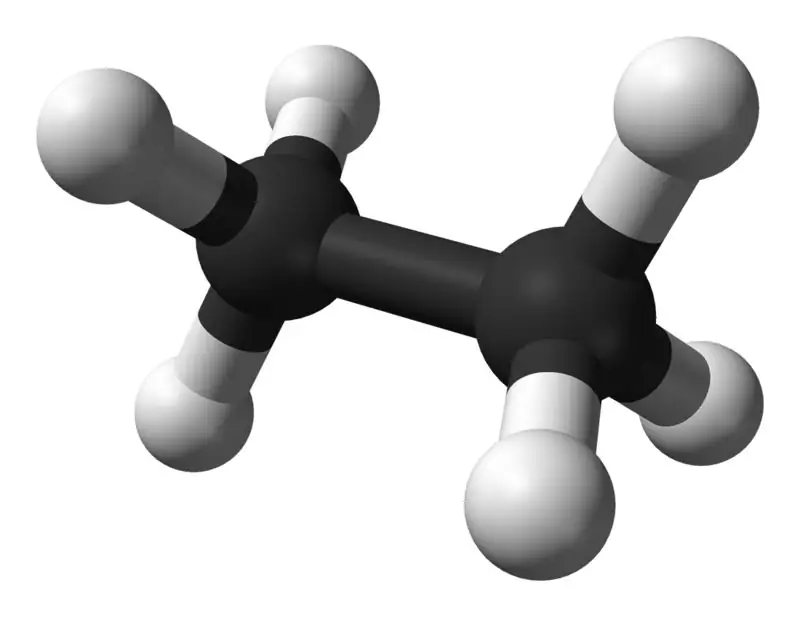
Etanas yra bespalvis, bekvapis dujinis junginys esant standartinei temperatūrai ir slėgiui. Jo molekulinė formulė ir molekulinė masė yra atitinkamai C2H6 ir 30,07 g·mol−1. Jis išskiriamas iš gamtinių dujų, kaip naftos perdirbimo proceso šalutinis produktas. Etanas yra labai svarbus etileno gamyboje.
Kuo skiriasi metanas ir etanas?
Metano ir Etano savybės
Struktūra:
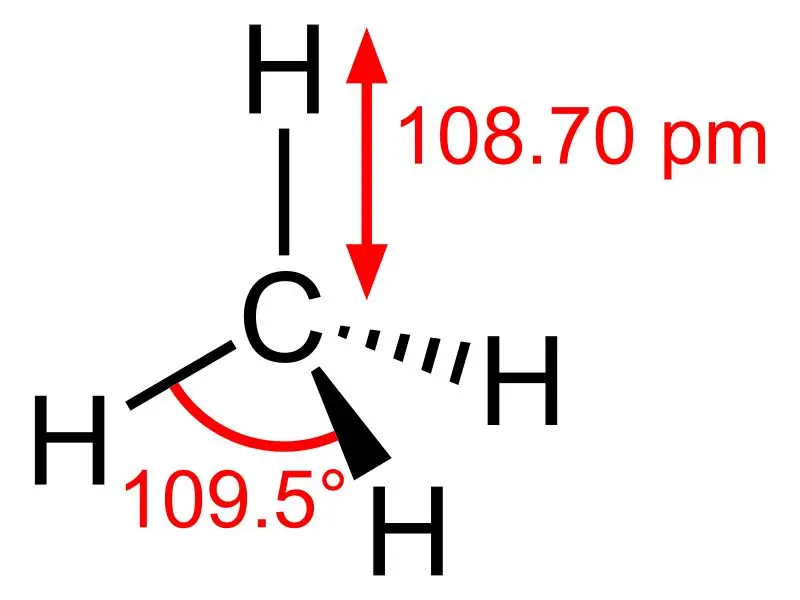
Metanas: metano molekulinė formulė yra CH4, ir tai yra tetraedrinės molekulės su keturiomis ekvivalentinėmis C-H jungtimis (sigma jungtimis) pavyzdys. Ryšio kampas tarp H-C-H atomų yra 109,50, o visos C-H jungtys yra lygiavertės ir yra lygus 108,70 pm.
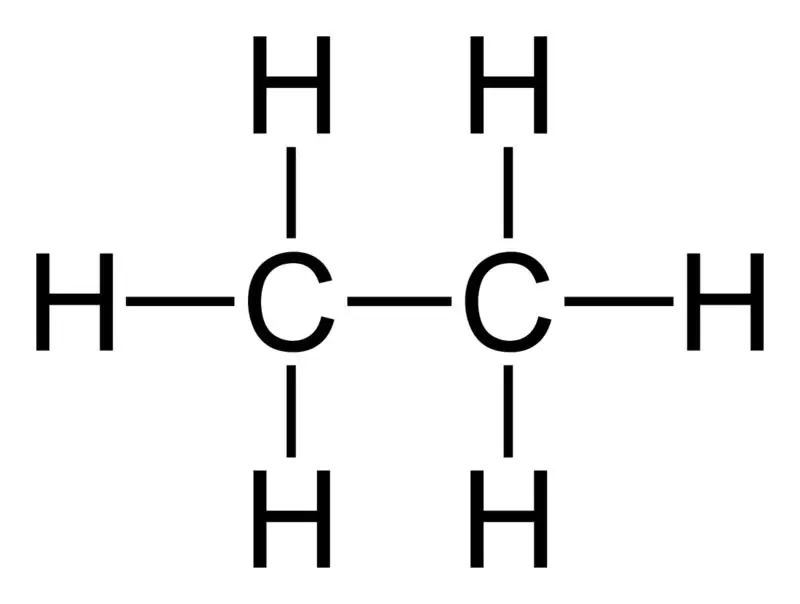
Etanas: Etano molekulinė formulė yra C2H6,ir yra sotusis angliavandenilis, nes jame nėra kelių jungčių.
Cheminės savybės:
Metanas:
Stabilumas: Metanas yra chemiškai labai stabili molekulė, kuri nereaguoja su KMnO4, K2Cr 2O7, H2SO4 arba HNO 3 įprastomis sąlygomis.
Degimas: Esant oro arba deguonies pertekliui, metanas dega šviesiai mėlyna nešviečia liepsna, gamindamas anglies dioksidą ir vandenį. Tai labai egzoterminė reakcija; todėl jis naudojamas kaip puikus kuras. Esant nepakankamam oro ar deguonies kiekiui, jis iš dalies sudega į anglies monoksido (CO) dujas.
Pakeitimo reakcijos: Metanas rodo pakeitimo reakcijas su halogenais. Šiose reakcijose vienas ar keli vandenilio atomai pakeičiami vienodu halogeno atomų skaičiumi ir tai vadinama „halogeninimu.” Esant saulės šviesai, jis reaguoja su chloru (Cl) ir bromu (Br).
Reakcija su garais: kai metano ir garų mišinys praleidžiamas per įkaitintą (1000 K) nikelį, esantį ant aliuminio oksido paviršiaus, gali susidaryti vandenilis.
Pirolizė: kai metanas kaitinamas iki maždaug 1300 K, jis suskaidomas iki suodžių ir vandenilio.
Etanas:
Reakcijos: Etano dujos (CH3CH3) reaguoja su bromo garais esant šviesai ir susidaro brometanas (CH) 3CH2Br) ir vandenilio bromidas (HBr). Tai pakeitimo reakcija; vandenilio atomas etane yra pakeistas bromo atomu.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Degimas: visiškai sudegus etanui, išsiskiria 1559,7 kJ/mol (51,9 kJ/g) šilumos, anglies dioksido ir vandens.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
Taip pat gali įvykti ir be deguonies pertekliaus, todėl susidaro amorfinės anglies ir anglies monoksido mišinys.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + energija
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + energija
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energija ir kt.
Apibrėžimai:
Pakeitimo reakcijos: pakeitimo reakcija yra cheminė reakcija, kurios metu viena funkcinė grupė pakeičiama cheminiame junginyje ir pakeičiama kita funkcine grupe.
Naudojimas:
Metanas: Metanas naudojamas daugelyje pramoninių cheminių procesų (kaip kuras, gamtinės dujos, suskystintos gamtinės dujos) ir transportuojamas kaip atšaldytas skystis.
Etanas: Etanas naudojamas kaip variklių kuras ir kaip š altnešis itin žemos temperatūros sistemose. Jis tiekiamas plieniniuose balionuose kaip suskystintos dujos, veikiant savo garų slėgiui.






