- Autorius Alex Aldridge [email protected].
- Public 2023-12-17 13:44.
- Paskutinį kartą keistas 2025-06-01 07:37.
Pagrindinis skirtumas tarp pirmos ir antros eilės reakcijų yra tas, kad pirmosios eilės reakcijų greitis priklauso nuo pirmosios reagento koncentracijos laipsnio greičio lygtyje, tuo tarpu antros eilės reakcijų greitis priklauso nuo antrosios koncentracijos laipsnio terminas kurso lygtyje.
Reakcijos tvarka yra jėgų, iki kurių pakyla reaguojančių medžiagų koncentracija greičio dėsnio lygtyje, suma. Pagal šį apibrėžimą yra keletas reakcijų formų; nulinės eilės reakcijos (šios reakcijos nepriklauso nuo reagentų koncentracijos), pirmos eilės reakcijos ir antros eilės reakcijos.
Kas yra pirmosios eilės reakcijos?
Pirmosios eilės reakcijos yra cheminės reakcijos, kurių reakcijos greitis priklauso nuo vieno iš reagentų, dalyvaujančių reakcijoje, molinės koncentracijos. Todėl pagal aukščiau pateiktą reakcijos eilės apibrėžimą, galių, iki kurių pakeliamos reaguojančių medžiagų koncentracijos greičio dėsnio lygtyje, suma visada bus 1. Šiose reakcijose gali dalyvauti arba vienas reagentas. Tada to reagento koncentracija lemia reakcijos greitį. Tačiau kartais šiose reakcijose dalyvauja daugiau nei vienas reagentas, tada vienas iš šių reagentų nulems reakcijos greitį.
Panagrinėkime pavyzdį, kad suprastume šią sąvoką. Skilimo reakcijoje N2O5 susidaro NO2 ir O 2 dujos kaip produktai. Kadangi jis turi tik vieną reagentą, reakciją ir greičio lygtį galime užrašyti taip.
2N2O5(g) → 4NO2(g) + O 2(g)
Kaina=k[N2O5(g)]m
Čia k yra šios reakcijos greičio konstanta, o m yra reakcijos eilė. Todėl, remiantis eksperimentiniais nustatymais, m reikšmė yra 1. Taigi tai yra pirmos eilės reakcija.
Kas yra antros eilės reakcijos?
Antros eilės reakcijos yra cheminės reakcijos, kurių reakcijos greitis priklauso nuo dviejų reagentų molinės koncentracijos arba nuo vieno reagento, dalyvaujančio reakcijoje, antrosios galios. Todėl pagal aukščiau pateiktą reakcijos eilės apibrėžimą, galių, iki kurių pakeliamos reaguojančių medžiagų koncentracijos greičio dėsnio lygtyje, suma visada bus 2. Jei reagentai yra du, reakcijos greitis priklausys nuo pirmosios laipsnio. kiekvienos reagento koncentracijos.
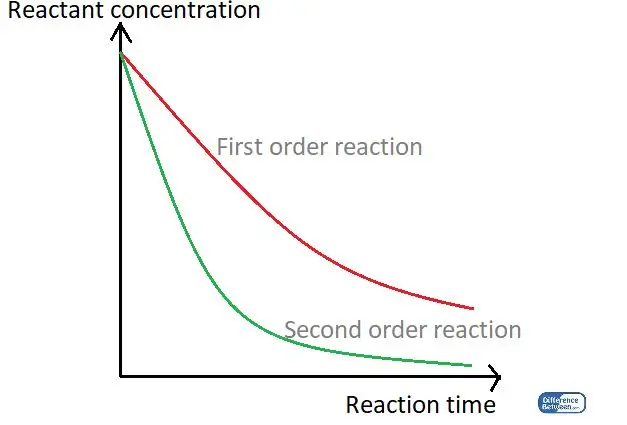
01 pav. Grafikas, kuriame lyginami dviejų tipų reakcijos, naudojant reakcijos laiką ir reagento koncentraciją.
Jeigu reagento koncentraciją padidinsime 2 kartus (jei greičio lygtyje yra du reagentai), tai reakcijos greitis padidėja 4 kartus. Pavyzdžiui, panagrinėkime tokią reakciją.
2A → P
Čia A yra reagentas, o P yra produktas. Tada, jei tai antros eilės reakcija, šios reakcijos greičio lygtis yra tokia.
Kaina=k[A]2
Tačiau reakcijai su dviem skirtingais reagentais, pvz., A + B → P
Įvertis=k[A]1[B]1
Kuo skiriasi pirmosios ir antrosios eilės reakcijos?
Pirmosios eilės reakcijos yra cheminės reakcijos, kurių reakcijos greitis priklauso nuo vieno iš reagentų, dalyvaujančių reakcijoje, molinės koncentracijos. Todėl padidinus reagento koncentraciją 2 kartus, reakcijos greitis padidėja 2 kartus. Antrosios eilės reakcijos yra cheminės reakcijos, kurių reakcijos greitis priklauso nuo dviejų reagentų molinės koncentracijos arba nuo vieno reagento, dalyvaujančio reakcijoje, antrosios galios. Vadinasi, padidinus reagento koncentraciją 2 kartus, reakcijos greitis padidės 4 kartus. Žemiau esančioje infografikoje lentelės forma pateikiamas skirtumas tarp pirmosios ir antrosios eilės reakcijų.

Santrauka - pirmosios ir antrosios eilės reakcijos
Yra trys pagrindiniai reakcijų tipai pagal reakcijos tvarką; nulinės eilės, pirmos eilės ir antros eilės reakcijos. pagrindinis skirtumas tarp pirmosios ir antrosios eilės reakcijų yra tas, kad pirmosios eilės reakcijos greitis priklauso nuo pirmosios reagento koncentracijos laipsnio greičio lygtyje, tuo tarpu antros eilės reakcijos greitis priklauso nuo antrosios koncentracijos termino laipsnio. normos lygtis.






