- Autorius Alex Aldridge [email protected].
- Public 2023-12-17 13:44.
- Paskutinį kartą keistas 2025-06-01 07:37.
Pagrindinis skirtumas tarp anglies rūgšties ir bikarbonato yra tas, kad anglies rūgštis yra neutralus cheminis junginys, o bikarbonatas yra neigiamo krūvio cheminis junginys.
Anglies rūgštis yra silpna rūgštis, kuri susidaro tirpale, kai anglies dioksidas ištirpsta vandenyje, cheminė formulė H2CO3. Bikarbonatas susidaro derinant tris deguonies atomus, vandenilio atomą ir anglies atomą, kurio cheminė formulė HCO3-.
Kas yra anglies rūgštis?
Anglies rūgštis yra H2CO3. Kartais šį pavadinimą suteikiame tirpalams, kurių anglies dioksidas ištirpintas vandenyje arba gazuotame vandenyje. Taip yra todėl, kad gazuotame vandenyje yra nedidelis H2CO3 kiekis. Be to, anglies rūgštis yra silpna rūgštis ir gali sudaryti dviejų tipų druskas kaip karbonatus ir bikarbonatus. Šio junginio molinė masė yra 62,024 g/mol.
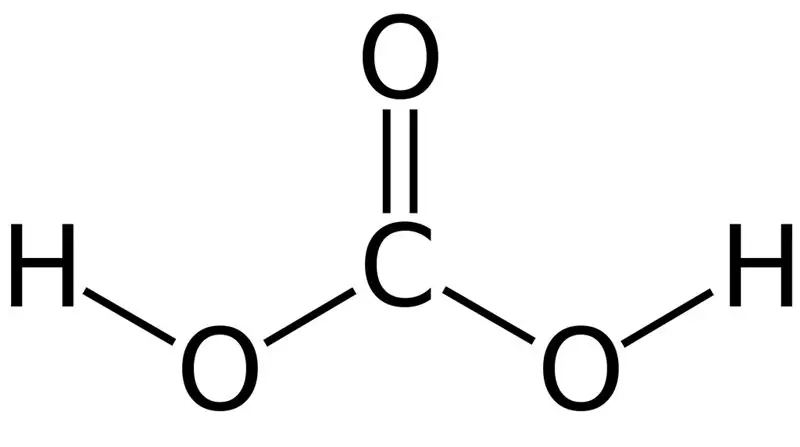
01 pav.: anglies rūgšties cheminė struktūra
Kai anglies dioksidas ištirpsta vandenyje, jis patenka į pusiausvyrą tarp anglies dioksido ir anglies rūgšties. Pusiausvyra yra tokia:
CO2 + H2O ⟷ H2CO3
Jei į bazę pridedame anglies rūgšties perteklių, gaunamas bikarbonatas. Tačiau, jei yra bazės perteklius, anglies rūgštis linkusi gaminti gazuotas druskas. Tiksliau sakant, anglies rūgštis yra karboksirūgšties junginys, turintis du hidroksilo grupės pakaitus, prijungtus prie karbonilo anglies. Be to, tai poliprotinė rūgštis, galinti dovanoti protonus. Jis turi du nuimamus protonus, todėl yra ypač diprotiškas.
Kas yra bikarbonatas?
Bikarbonatas susidaro derinant tris deguonies atomus, vandenilio atomą ir anglies atomą. Šio derinio produktas gali būti jonas arba junginys, turintis daugiau elektronų nei protonų. Galime jį apibūdinti kaip cheminę rūšį, kurios cheminė formulė HCO3-.
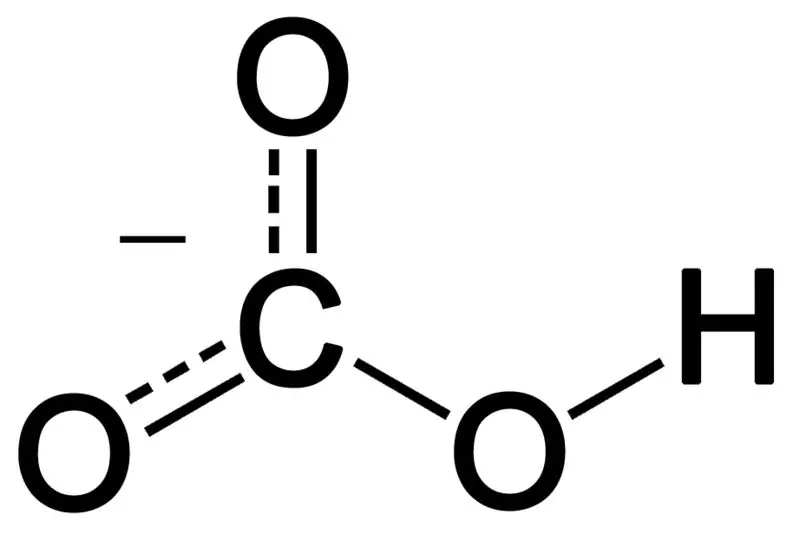
02 pav.: Bikarbonato anijono cheminė struktūra
Šis junginys yra esminė organizmo pH buferinės sistemos dalis, liaudiškai tariant: jis atsakingas už tai, kad kraujas būtų ne per rūgštus ar per šarminis. Be to, jis padeda kontroliuoti virškinimo sultis, kai skrandis baigia virškinti maistą. Be to, anglies rūgštis lietaus vandenyje sudaro bikarbonato jonus, kai atsitrenkia į akmenis. Šis bikarbonato jonų srautas yra svarbus norint išlaikyti anglies ciklą.
Kuo skiriasi anglies rūgštis ir bikarbonatas?
Anglies rūgštis yra silpna rūgštis, kuri susidaro tirpale, kai anglies dioksidas ištirpsta vandenyje, o jos cheminė formulė yra H2CO3. Bikarbonatas susidaro derinant tris deguonies atomus, vandenilio atomą ir anglies atomą, kurio cheminė formulė HCO3-. pagrindinis skirtumas tarp anglies rūgšties ir bikarbonato yra tas, kad anglies rūgštis yra neutralus cheminis junginys, o bikarbonatas yra neigiamai įkrautas cheminis junginys. Be to, anglies rūgštis naudojama ruošiant putojančius, gazuotus gėrimus, gydant dermatitus, burnos skalavimo skystyje ir kt., o bikarbonatas naudojamas maisto ruošimui, pavyzdžiui, kepiniams (kaip rauginimo medžiaga), ir suteikia galimybę atsispirti pH pokyčiams.
Toliau pateiktoje infografijoje lentelės pavidalu apibendrinamas anglies rūgšties ir bikarbonato skirtumas, kad būtų galima palyginti.
Santrauka - anglies rūgštis prieš bikarbonatą
Anglies rūgštis yra H2CO3. Bikarbonatas susidaro susijungus iš trijų deguonies atomų, vandenilio atomo ir anglies atomo, kurio cheminė formulė yra HCO3-. pagrindinis skirtumas tarp anglies rūgšties ir bikarbonato yra tas, kad anglies rūgštis yra neutralus cheminis junginys, o bikarbonatas yra neigiamo krūvio cheminis junginys.






